Obwohl die STIKO - wie hier ausführlich dargelegt - einräumt, dass die Häufigkeit der schon immer seltenen Men B-Erkrankungen "deutlich und stetig" zurückgeht, empfiehlt sie seit Januar 2024 allen Säuglingen die MenB-Impfung. Lesen Sie hier, was Sie über die Impfstoffe wissen müssen.
Der bei MenA, C, W und Y verwendete Ansatz, Kapselpolysaccharide als Ziel-Antigene der Impfstoffe zu verwenden, verbot sich bei MenB, da hier diese Polysaccharide kreuzreaktiv mit menschlichem Gewebe sind und damit Autoimmunerkrankungen als Folge der Impfung gedroht hätten (Pizza 2000). Daher werden bei den MenB-Impfstoffen subkapsulär gelegene Proteinstrukturen als Antigene verwendet.
International werden derzeit 2 unterschiedliche Impfstoffe gegen MenB verwendet:
4CMenB (Bexsero™)
enthält 4 Oberflächenantigene von MenB, gewonnen durch rekombinante DNA-Technologie, gebunden an Aluminiumhydroxid (0,5 mg Aluminium/Impfdosis)
zugelassen ab dem Alter von 2 Monaten
MenB-fHbp (Trumenba™)
lipidierte Oberflächenantigene, gewonnen durch rekombinante DNA-Technologie, gebunden an Aluminiumphosphat (0,25 mg Aluminium/Impfdosis)
zugelassen ab dem Alter von 10 Jahren
Die Zulassung beider MenB-Impfstoffe beruhte (lediglich) auf ihrer Immunogenität, d.h. auf dem Nachweis von als schützend angesehenden Antikörpern nach der Impfung, nicht auf dem klinischen Nachweis eines Schutzes oder eines verringerten Erkrankungsrisikos. Zudem wurde die Immunogenität nur gegen einige wenige, ausgewählte (Indikator-)Stämme überprüft, die nicht repräsentativ mit pathogenen Wildstämmen sind (Stephens 2023). Das relativiert auch die Aussagen zur Immunogenität, da sich diese auf eben die vom Hersteller bewusst ausgewählten Stämme mit optimaler Wirksamkeit beziehen - real-world-Daten zeigen, dass die klinisch relevante Immunogenität gegen tatsächlich auftretende Wildvirus-Stämme oft deutlich geringer ist (Stephens 2023).
Die üblichen Phase 3-Studien, in denen randomisiert die klinische Wirksamkeit von Impfstoffen überprüft werden, wurden bei MenB-Impfstoffen "wegen der Seltenheit der Erkrankungen" nicht durchgeführt (Stephens 2023).
Somit beruhen Behauptungen zur Wirksamkeit der Impfstoffe lediglich auf Beobachtungsstudien, der methodisch schwächsten Form eines Wirksamkeitsnachweises, weil diese zahlreichen potentiellen Fehlerquellen unterliegen. Gerade in Zeiten, in denen z.B. in den USA und Europa die Inzidenz von MenB-Erkrankungen ohnehin Jahr für Jahr deutlich zurückgeht (s. hier), ist es methodisch herausfordernd, hier den Effekt einer eingeführten Impfung zuverlässig zu identifizieren (so ist die oft angeführte Behauptung derartiger Studien, in den Jahren nach der Einführung der Impfung seien die Fallzahlen um x% zurückgegangen, isoliert betrachtet irreführend, da sie im selben Zeitraum auch ohne die Impfung um y% zurückgegangen wären). Die durch die Seltenheit der Erkrankung bedingt geringen absoluten Fallzahlen erschweren belastbare Aussagen zusätzlich.
Bexsero™
Meningokokken B lassen sich noch einmal in eine Vielzahl unterschiedlicher "Stämme" unterteilen, von denen nicht alle die im 4CMenB enthaltenen Oberflächenantigene aufweisen:
eine retrospektive Analyse über die Jahre 2007/2008 schätzte, dass etwa 82% der nachgewiesenen MenB-Stämme durch den Impfstoff abgedeckt gewesen wären, im Zeitraum 2007 - 2013 waren es nur noch 68% (Claus oJ). Neuere Daten liegen hier - 10 Jahre nach der Zulassung des Impfstoffs und im Jahr der Impfempfehlung (!) - nicht vor. Vergleichbare Daten gibt es z.B. aus Großbritannien: waren in den Jahren 2007/2008 noch fast drei Viertel aller Meningokokken B-Stämme in Großbritannien durch den Impfstoff abgedeckt, nahm dieser Anteil bis 2014/15 auf knapp zwei Drittel der Serotypen ab (Parikh 2017).
Trumenba™
Hier zitiert das RKI Immunogenitätsstudien, die zeigen, dass (lediglich) 70 - 80% der Grundimmunisierten Antikörper-Spiegel erreichen, die als schützend angesehen werden. Die Schwankungsbreite der Ergebnisse war mit 24 - 100% darüber hinaus ungewöhnlich groß (RKI 2024) (zum Vergleich: diese Werte liegen für die Masernimpfung im zweiten Lebensjahr bei verlässlich ≥ 95%).
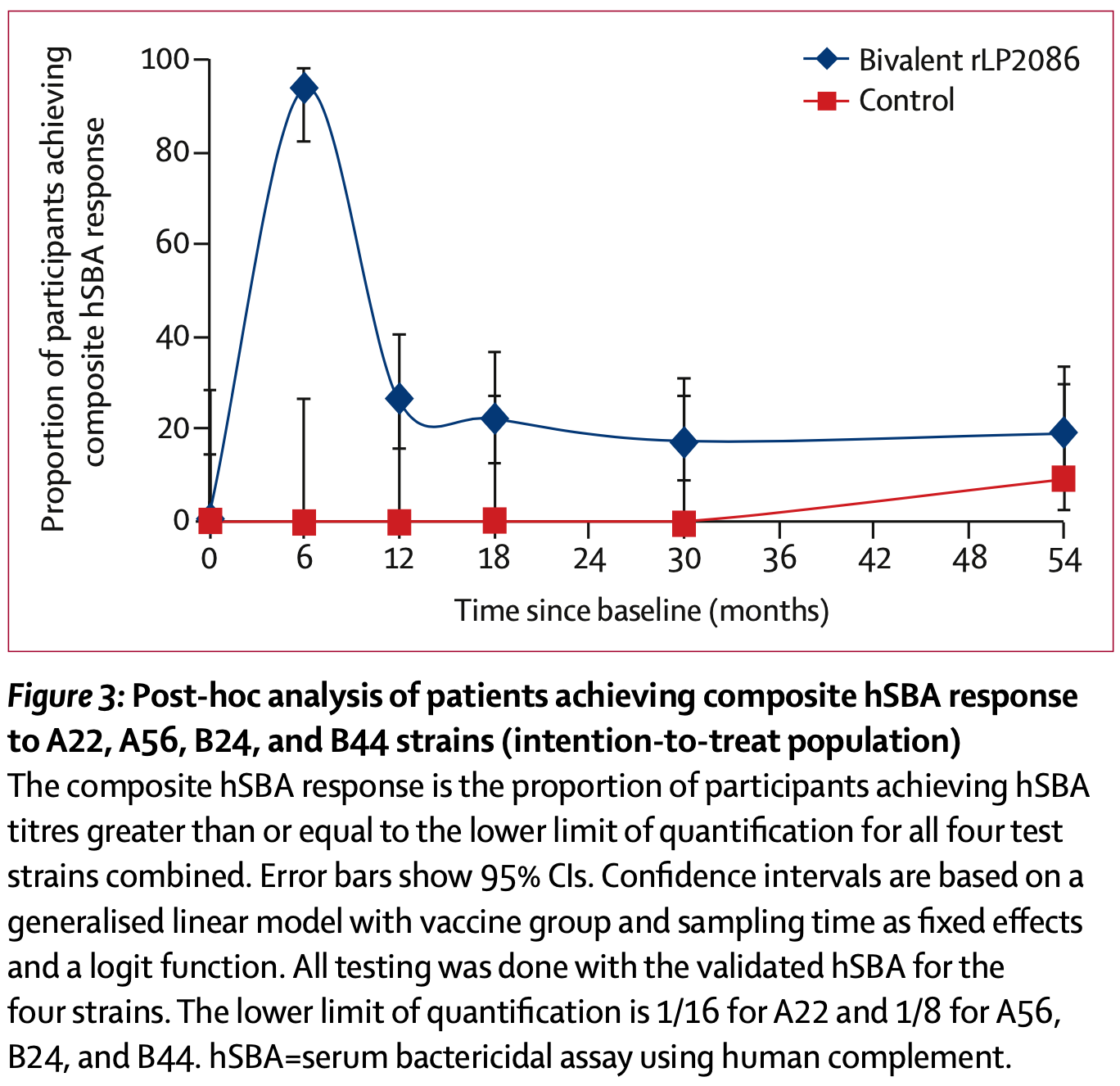
Eine vom Impfstoff-Hersteller Pfizer selbst durchgeführte Studie an Jugendlichen zeigte zudem ein rasches Absinken der erreichten Antikörperspiegel (gegen 4 von Pfizer handverlesene Test-Stämme): schon 12 Monate nach der Impfung überlappten sich die Vertrauensbereiche zwischen der Impfgruppe und der Kontrollgruppe (die als "Placebo" einen Hepatitis A-Impfstoff (!) erhalten hatte) - dies blieb bis zum Studienende 4 1/2 Jahre nach der Impfung so (Marshall 2016).
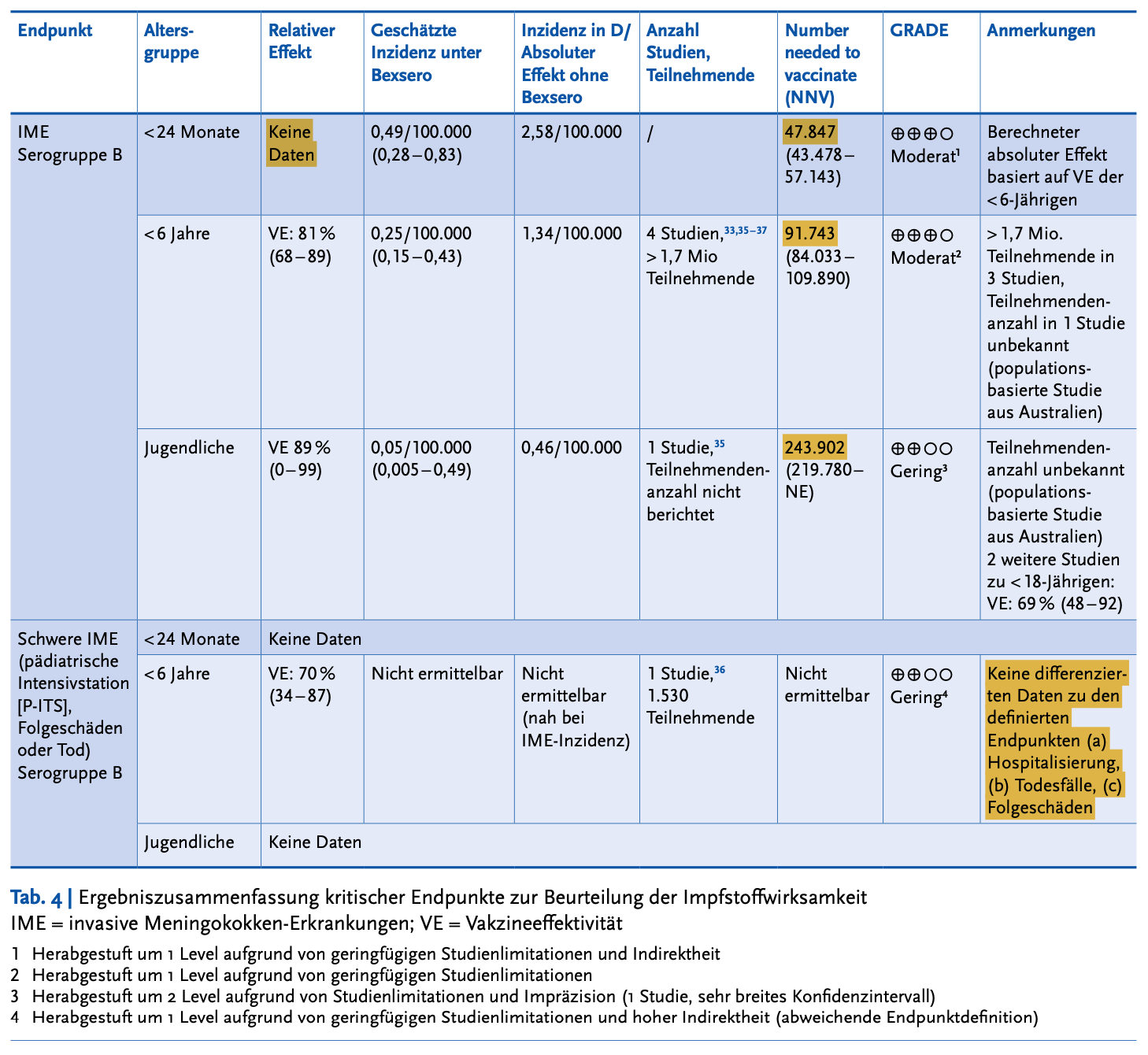
Die derzeit zur Verfügung stehenden Studien zur Wirksamkeit der Impfstoffe werden vom RKI wissenschaftlich aufbereitet, nach ihrer Verlässlichkeit beurteilt und in der folgenden Tabelle zusammengefasst:
(RKI 2024)
Zusammenfassend:
-
Es gibt keine Daten zur Impfstoff-Effektivität bei der Zielgruppe der neuen Impfempfehlung, den Säuglingen bis zum Alter von 24 Monaten.
-
Es gibt keine Daten zur Impfstoff-Effektivität zum Verhindern von schweren Verläufen, Folgeschäden oder Todesfällen durch die Impfung - für kein Lebensalter.
-
Die (überwiegend sehr grob geschätzte) Zahl der Kinder und Jugendlichen, die geimpft werden müssten, um einen Erkrankungsfall zu verhindern (NNV - number needed to vaccinate) lautet für Säuglinge fast 50.000, für Kleinkinder fast 100.000 und für Jugendliche fast 250.000.
-
Es gibt keine Daten zur Wirkdauer der MenB-Impfung - sehr wohl aber Metaanalysen, die schon 6 Monate nach der 3. Impfdosis ein deutliches Absinken der Antikörper-Spiegel nachweisen (Flacco 2018).
-
Keiner der beiden Impfstoffe beeinflusst den Trägerstatus mit MenB, es gibt also keinerlei Herdenimmunität
Epidemiologische Wirksamkeit
Die Situation in D zu Grunde legende Modellierungen gehen davon aus, dass eine flächendeckende MenB-Impfung, wie jetzt von der STIKO empfohlen, selbst in der Zielgruppe maximal 15% der auftretenden MenB-Fälle verhindern könnte (RKI 2024).
Aufgrund der fehlenden Herdenimmunität sind Schutzeffekte außerhalb der Zielgruppe ohnehin nicht zu erwarten.
Keine der (auch international) vorliegenden Berechnungen geht daher von einer Kosteneffektivität der MenB-Impfung aus.
Bexsero™
Neben der wenig überzeugenden Datenlage zur Wirksamkeit der MenB-Impfung war es vor allem die von Anfang an auffallend schlechte Verträglichkeit der Impstoffe, die die STIKO noch 2023 von einer Impfempfehlung Abstand nehmen ließ. Schon 2013 schrieb sie, dass "insbesondere starke Schmerzen an der Einstichstelle ... häufiger nach Bexsero® ... als nach Standardimpfungen ... berichtet [wurden]". Auch "Reizbarkeit, ungewöhnliches Weinen, Schläfrigkeit, Erbrechen und Durchfall [wurden] beobachtet, meist häufiger als nach Standardimpfungen allein.". Früh wurden auch schwere mögliche Nebenwirkungen wie die immunologische Entzündung der Herzkranzgefäße - das so genannte Kawasaki-Syndrom - nach der Impfung beobachtet (RKI 2013). In der Sicherheitsanalyse, die die STIKO der MenB-Impfempfehlung beilegt, gibt es keine belastbaren Daten, die das Risiko eines Kawasaki-Syndroms ausschließen könnten.
Speziell bei Bexsero™ gilt wieder einmal, dass schon die Zulassungsstudien nicht konsequent gegen wirkliches Placebo, sondern gegen andere, teilweise exotische, Impfstoffe (wie den gegen japanische Enzephalitis...) durchgeführt wurden.
Trumenba™
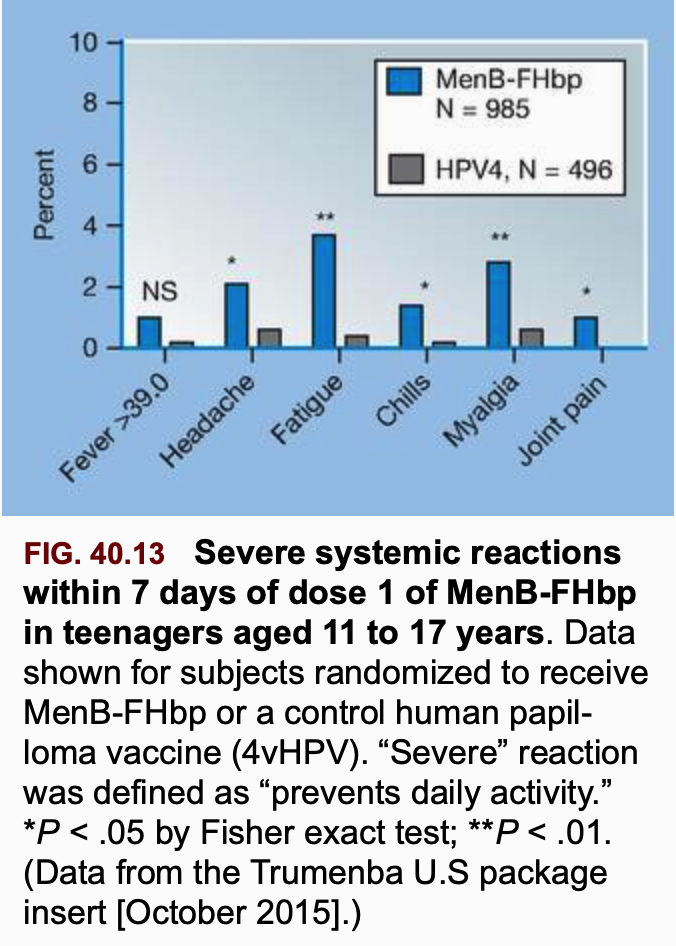
Bei Trumenba™ musste eine erste Studie an Säuglingen wegen der häufigen schweren Fieberreaktionen abgebrochen werden - Pfizer stellte daraufhin die Bemühungen um eine Zulassung auch für Säuglinge ein (Stephens 2023). Bei Jugendlichen zeigt selbst eine Studie, in der die Verträglichkeit des Impfstoffs nicht etwa im Vergleich zu Placebo, sondern zu einem ebenfalls tendentiell hochreaktogenen HPV-Impfstoff untersucht wurde, die selbst in diesem unwissenschaftlichen setting auffallend schlechte Verträglichkeit (Graphik Stephens 2023):
Zusammenfassend
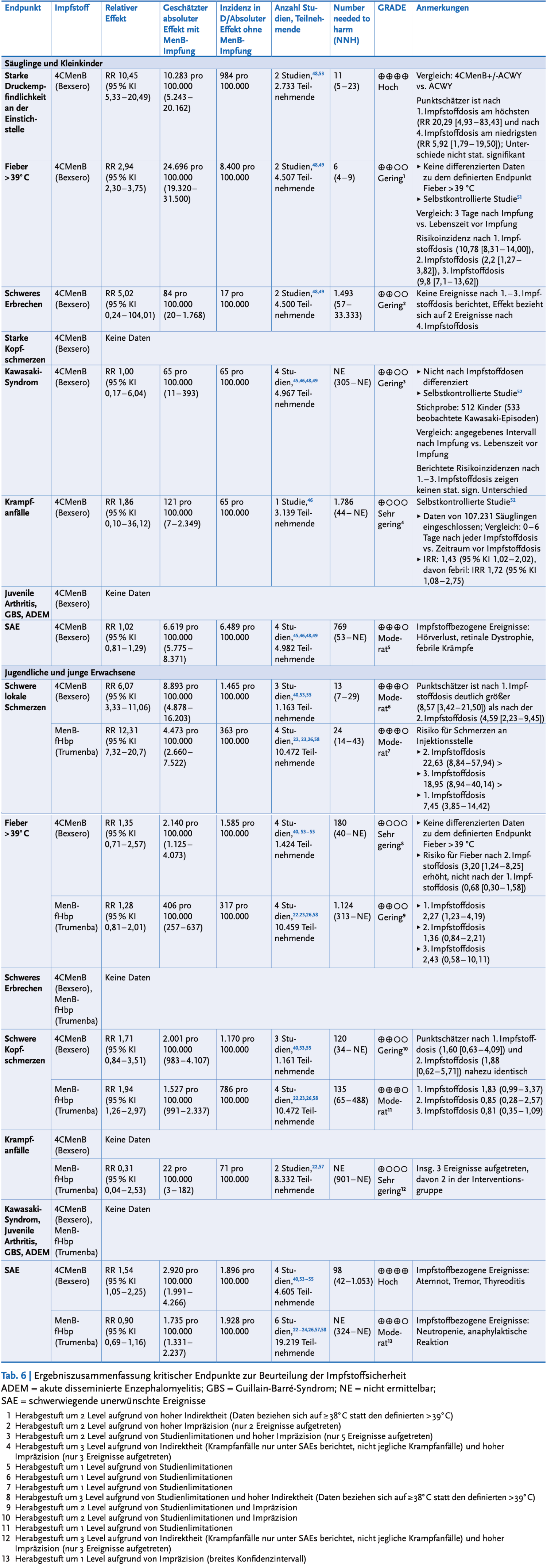
Insgesamt ist die Datenlage zur Sicherheit der Impfstoffe unbefriedigend, die teilweise abstrus großen Vertrauensbereiche (VB) der von der STIKO aus der Literatur herausgelesenen Häufigkeiten (NNH - number needed to harm) führen die genannten Zahlen weitestgehend ad absurdum: so wird "schweres Erbrechen" mit einer NNH von 1 : 1493 angegeben, der VB reicht jedoch von 57 - 33.333... auch deswegen sind als zusätzlich einschränkender Faktor die GRADE-Einschätzungen (ein Maß für die wissenschaftliche Verlässlichkeit der Daten) überwiegend niedrig oder sehr niedrig.
Eine in ihrer Differenziertheit erschlagende, aufgrund der genannten Einschränkung der Datenqualität aber letztendlich wenig erhellende Übersicht zu den untersuchten Nebenwirkungen liefert das RKI bei der wissenschaftlichen Begründung der Impfempfehlung:
Verträglichkeit
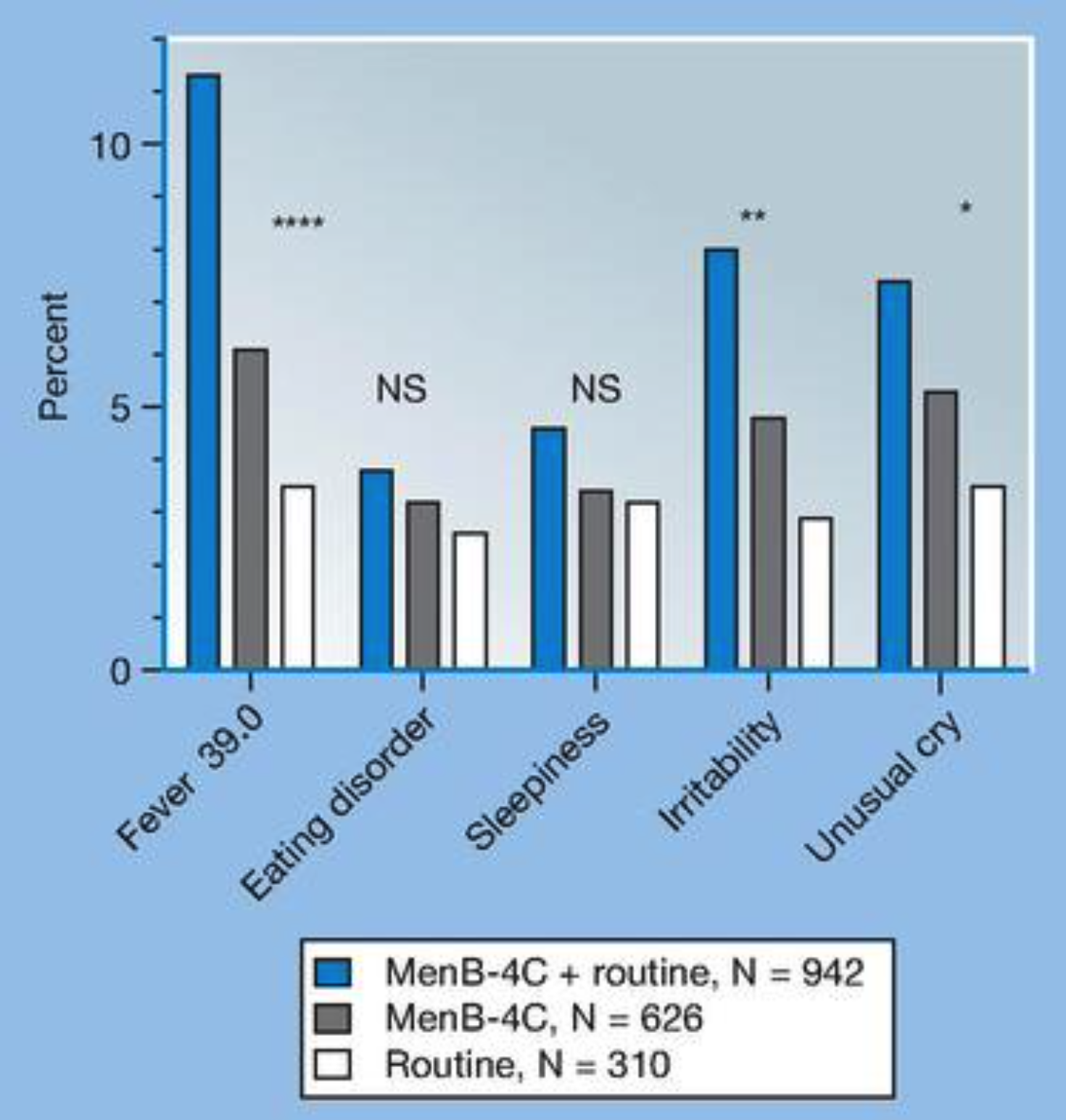
Die STIKO-Empfehlung sieht die Anwendung von Bexsero™ ausdrücklich zeitgleich mit 2 anderen Impfstoffen (der 6-fach-Impfung und der Pneumokokken-Impfung) am selben Tag vor, der 9 Wochen alte Säugling erhält also nach dieser Empfehlung drei Injektionen gleichzeitig an jeweils 3 Terminen im ersten Lebensjahr. Die ohnehin auch von der STIKO eingeräumte "hohe Reaktogenität" (vulgo: Schmerzhaftigkeit und schlechte Akutverträglichkeit) wird durch diese Kombination noch schlechter, wie eine europäische Studie schon 2012 zeigte: Fieber, Reizbarkeit und auffälliges Schreien waren bei gleichzeitiger Verabreichung von MenB und den sonstigen Routineimpfungen noch einmal signifikant häufiger, als bei MenB alleine (und für beide Verabreichungen häufiger als bei den Routineimpfungen allein) (Daten aus Gossger 2012, Graphik aus Stephens 2023).
Ganz vergleichbare Daten fand auch eine andere europäische Studie von 2013 (Vesikari 2013): auch hier waren systemische Nebenwirkungen nach der Kombination von MenB und Routineimpfungen konstant deutlich häufiger als nach den Routineimpfungen allein:
Wirksamkeit
Aber nicht nur die Verträglichkeit, sondern auch die Wirksamkeit leidet unter der neuen Kombinationsempfehlung: schon die reine Kombination von MenB und Routineimpfungen führte zu messbar niedrigeren Antikörpertitern von Teilen der (ohnehin schlecht wirksamen) Keuchhusten- und (ebenfalls ohnehin schlecht wirksamen Pneumokokkenimpfung (Snape 2010).
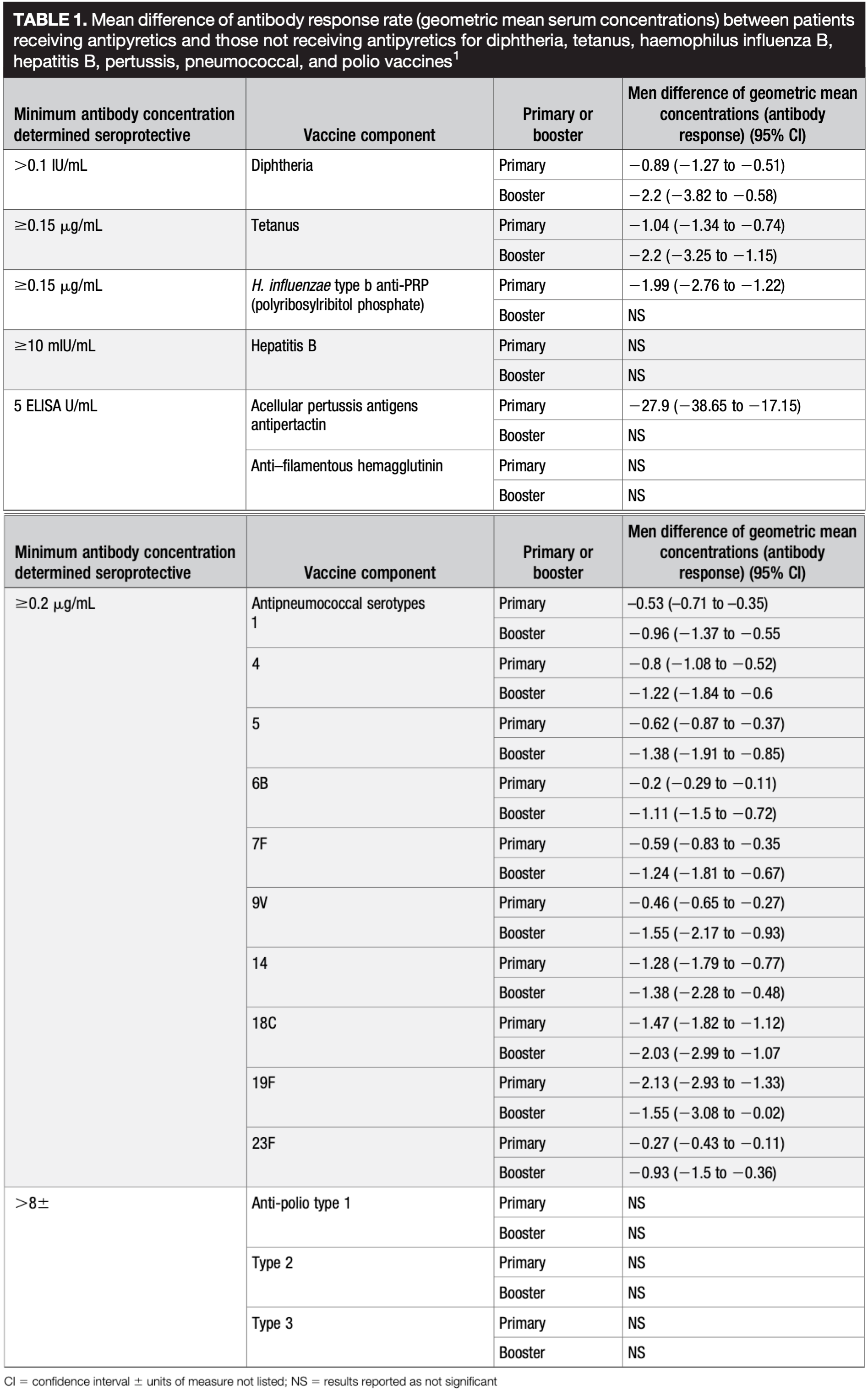
Die STIKO empfiehlt für diese Kombination (wie viele andere Impfkommissionen auch) die routinemäßige Gabe schmerzstillender und fiebersenkender Medikamente nach der Impfung, um deren Schmerzhaftigkeit und regelmäßige Fieberreaktion abzumildern. Es ist seit Jahren bekannt, dass auch diese Strategie zu einer deutlich messbaren Verringerung der Antikörperbildung nach Routineimpfungen führt: zahlreiche Studien konnten nachweisen, dass auch hier vor allem die Impfstoffe mit einer ohnehin geringen Effektivität betroffen sind (Pertussis und Pneumokokken), aber auch die Antikörperspiegel nach Tetanus- und teilweise Diphtherie-Impfung. Die Titer blieben in den Studiengruppen mit prophylaktischer Fiebersenkung auch nach späteren booster-Dosen niedriger (Brown 2020 (Tabelle), Wysocki 2017, Prymula 2009 und andere).
Das Verhalten der STIKO im Umgang mit der MenB-Impfung erinnert verhängnisvoll an ihren Kotau in der Coronoia:
Lange (10 Jahre lang) hat die STIKO Jahr für Jahr akribisch die Kritikpunkte aufgelistet, die ihrer Ansicht nach einer allgemeinen Impfempfehlung entgegenstehen: schlechte Akutverträglichkeit, der Verdacht auf schwere Nebenwirkungen, unklare Datenlage zur klinisch relevanten Wirksamkeit, unklare Datenlage zum Effekt auf Komplikationen und Todesfälle, unklare Wirksamkeit bei Risikopatienten mit chronischen Vorerkrankungen, unklare Datenlage zum public-health-Effekt, unklare Datenlage zu einem Herdenschutz etc. .
Die "wissenschaftliche Begründung" der STIKO für diese Impfempfehlung fasst diese für eine Schutzimpfung vernichtende Datenlage akribisch zusammen:
Keiner dieser Kritikpunkte kann bis heute mit wissenschaftlich belastbaren Daten entkräftet werden, im Gegenteil: beim in jeder Impfdiskussion immer so zentralen Punkt des Fremdschutzes herrscht mittlerweile ernüchternde Klarheit: es gibt keinerlei Herdenimmunität durch die MenB-Impfung.
Wie die Mitglieder der scheidenden STIKO diese Datenlage jetzt für eine 180-Grad-Kehrtwende verwenden lässt den wissenschaftlich Interessierten sprach-, ja fast atemlos zurück.
Brown C. 2020. Evidence-Based Practice, 23(2), 44–46. doi:10.1097/EBP.0000000000000629
Claus, H., et al. Meningococcal antigen typing system (MATS) based coverage for Bexsero on invasive MenB strains isolated from infants aged less than one year in Germany 2007–2013 (zitiert nach RKI 2024)
Flacco ME. 2018. The Lancet Infectious Diseases.
Gossger N. 2012. JAMA. 2012;307(6):573-582
Parikh SR. Lancet Infect Dis. 2017 Mar 30. pii: S1473-3099(17)30170-6. doi: 10.1016/S1473-3099(17)30170-6.
Pizza M., Scarlato V., Masignani V., et al., Identification of vaccine candidates against serogroup B meningococcus by whole-genome sequencing. Science. 2000;287:1816–1820.
Prymula R. 2009. https://doi.org/10.1016/S0140-6736(09)61208-3
RKI. 2024. EpiBull 3/24
RKI. 2013. EpiBull 49/2013
Snape MD. 2010. Pediatr Infect Dis J. 2010;29:e71–e79
Stephens DS. 2023. in Plotkin's Vaccines, 8th edition, 2023
Vesikari T. 2013. Lancet 2013; 381: 825–35
Wysolcki J. 2017. https://doi.org/10.1016/j.vaccine.2017.02.035