impf-info.de
Influenza - mRNA-Impfstoff von Moderna: mäßig wirksam, auffallend schlecht verträglich
Normalerweise ignoriere ich Impfstoff-Studien, die die Herstellerfirmen selbst durchführen und veröffentlichen - wenn aber, wie hier, diese Studien trotz aller Glättung beunruhigende Ergebnisse zeitigen, ist dies um so interessanter:
Moderna testete einen Influenza mRNA-Impfstoff (mRNA-1010) in einer ersten Studienphase gegen Placebo und einer zweiten Phase gegen einen konventionellen Influenza-Impfstoff - untersucht wurde in Phase I auf Sicherheit, in Phase II auf Sicherheit und Immunogenität, also die Provokation einer Antikörperbildung.
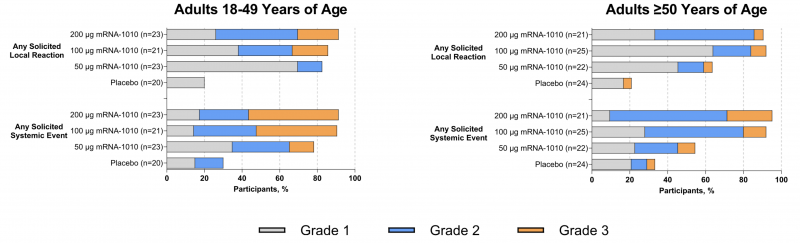
Die Nebenwirkungen waren klar dosisabhängig und schon bei der mittleren der drei getesteten Impfdosen klagten über 90% der Teilnehmer über systemische Nebenwirkungen wie Kopfschmerzen, Schwäche, Muskelschmerzen und Schüttelfrost. In der Gruppe der 18 - 49-Jährigen wurden diese Nebenwirkungen bei bis zu fast der Hälfte der Teilnehmer (47,8%) als "grade 3" klassifiziert - was eine schwere UAW mit notwendiger Hospitalisierung bedeutet. Bei den über 50-Jährigen war dies bei immerhin bei bis zu einem knappen Viertel (23,8%) der Fall.
Auch im unmittelbaren Vergleich zum konventionellen Influenza-Impfstoff zeigte sich, dass mRNA-1010 substantiell häufiger schwere UAWs auslöste.
Die Immunogenität war im Vergleich bei Influenza A-Stämme etwas höher, bei B in etwa vergleichbar.
Es spricht Bände, dass der Hersteller das Sicherheitsprofil eines Impfstoffs, bei der - je nach Dosis und Alter - fast die Hälfte der Geimpften wegen schwerer Nebenwirkungen stationär behandelt werden muss, als "acceptable" bezeichnet...

Safety and immunogenicity of a phase 1/2 randomized clinical trial of a quadrivalent, mRNA-based seasonal influenza vaccine (mRNA-1010) in healthy adults: interim analysis | Nature Communications
By accepting you will be accessing a service provided by a third-party external to https://www.impf-info.de/