Im von Jahr zu Jahr zunehmenden Chor der Impfempfehlungen für Schwangere gibt es einen neuen Mitsänger: die RSV-Impfung.
s. bitte hier
Nachdem die Entwicklung eines RSV-Impfstoffs für die von schweren Krankheitsverläufen besonders bedrohten Säuglinge und Kleinkinder - nach katastrophalen Fehlschlägen - bis heute (Juli 2023) erfolglos blieb, untersuchten mehrere Impfstoffhersteller, ob, wenn man Schwangere mit den - primär für ältere Erwachsene - entwickelten Protein-Impfstoffe impft, nicht ein "Nestschutz" für das Neugeborene in den ersten Lebenswochen entstünde.
GlaxoSmithKline brach die Studien mit seinem Protein-Impfstoff RSVPreF3 OA ab, nachdem erste Zwischenergebnisse ein deutlich erhöhtes Frühgeburtsrisiko der geimpften Frauen ergeben hatten.
Pfizer führte die Studien mit seinem pharmakologisch fast identischen Impfstoff jedoch weiter und erhielt mittlerweile auf der Grundlage der so genannten MATISSE-Studie (Kampmann 2023) die (Empfehlung der) Zulassung in den USA und der EU - in der EU im "beschleunigten Verfahren" (wegen des behaupteten "major public health interest" (EMA 2023a)). In der MATISSE- Studie wurde jeweils etwa 3600 Schwangere mit RSVpreF oder Placebo geimpft, untersucht wurde die Häufigkeit (schwerer) RSV-Infektionen der unteren Atemwege bei den Neugeborenen/jungen Säuglingen innerhalb der ersten 90 bzw. 180 Lebenstage.
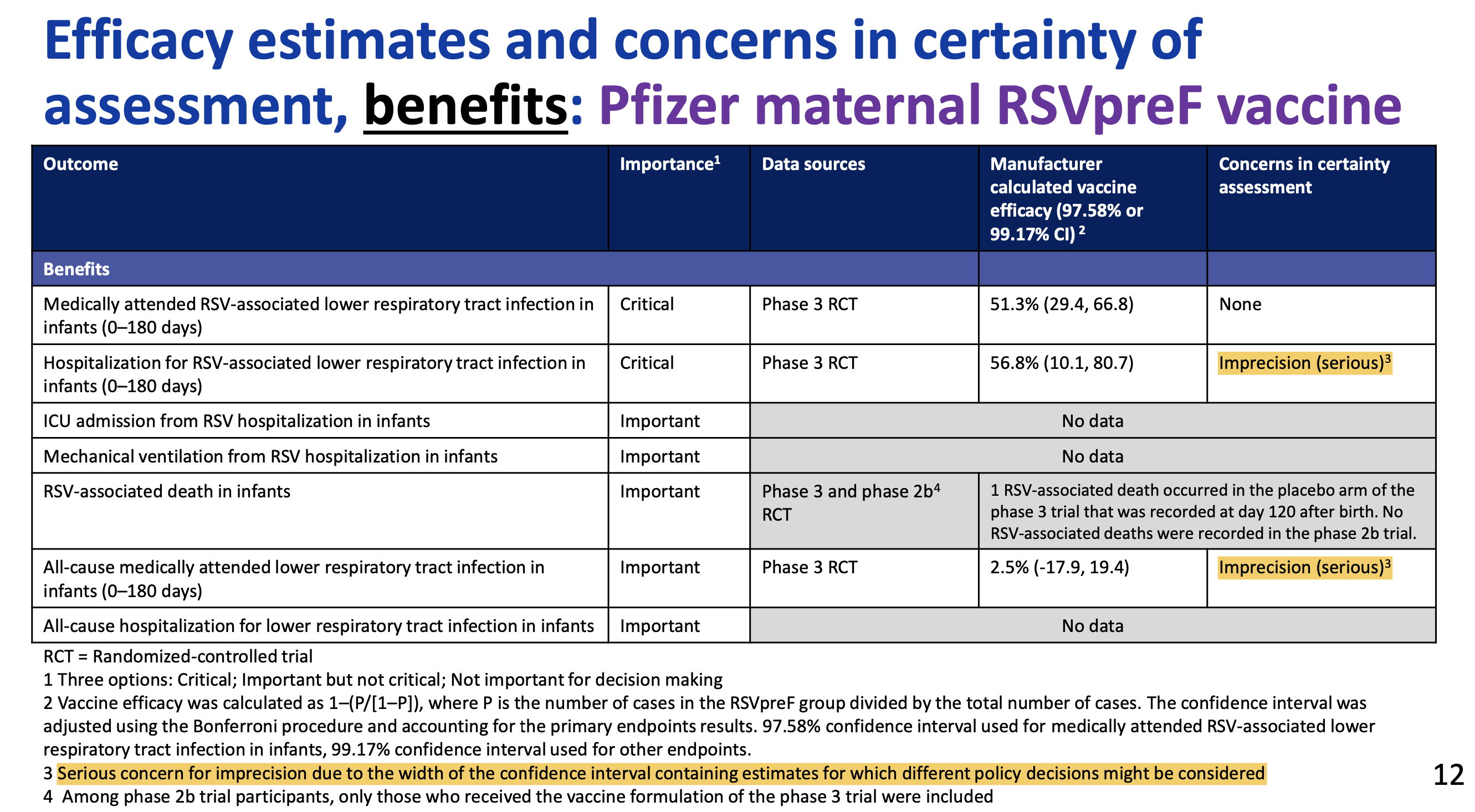
Das primäre Studienziel - Verhindern von RSV-Infektionen der unteren Atemwege (LRTI für lower respiratory tract infections) innerhalb der ersten 90 Lebenstage - wurde mit einer Impfstoff-Effektivität von nur 57,1% und einem unteren Wert des Vertrauensbereichs von 14,7% nicht erreicht.
Das Risiko schwerer Verläufe dieser LRTI wurde im selben Zeitraum jedoch um 81,8% verringert, allerdings auch hier mit einem sehr großen 99,5%-Vertrauensbereich von 40,6 - 96,3%. Wie immer sind dies Angaben zur relativen Risikoverringerung RRR.
Das absolute Risiko eines Kindes, in den ersten 90 Lebenstagen an einer schweren RSV-Infektion der unteren Atemwege zu erkranken wurde durch die Impfung von (gerundet) 0,93% auf 0,19% verringert, die absolute Risikoverringerung ARR beträgt mithin 0,76%.
Um einen Fall einer schweren LRTI zu verhindern müssten nach diesen Zahlen 132 Schwangere geimpft werden (number needed to vaccinate NNV).
Wie zuverlässig ist dieser Wissensstand?
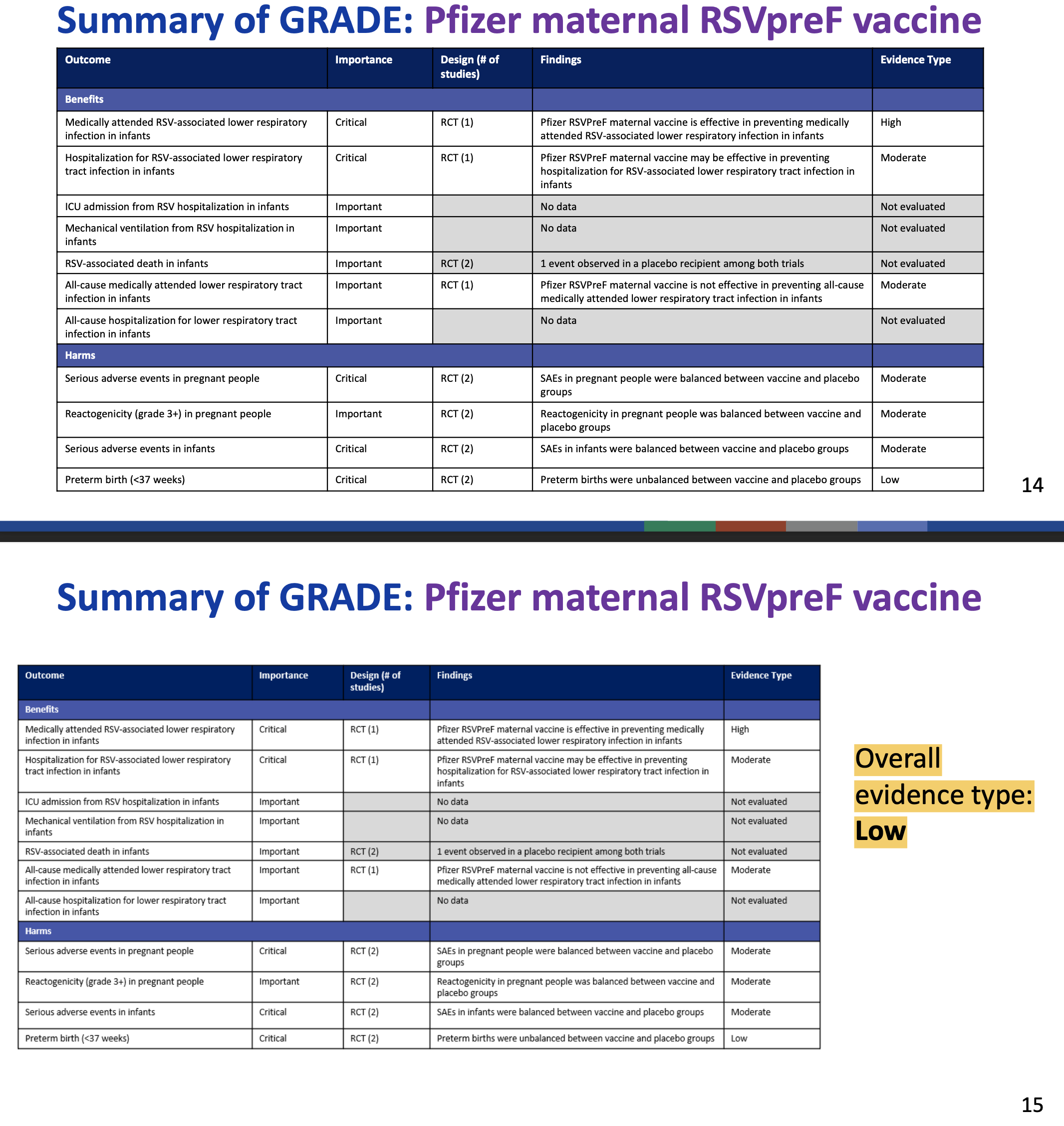
Die US-amerikanischen CDC (CDC 2024, CDC 2023) bewerteten den Wissensstand zum Nutzen von Abrysvo™ im Mai 2023 und September 2024 nach dem so genannten GRADE-Schema (das auch z.B. die STIKO zur Impfstoff-Bewertung benutzt):
Mit anderen Worten: die CDC haben zur Verlässlichkeit jedes einzelnen behaupteten Nutzens dieses Impfstoffs (insofern überhaupt Daten vorliegen) ernste Bedenken.
Frühgeburtlichkeit
Im Mai 2023 erschien im renommierten British Medical Journal ein Aufruf namhafter Wissenschaftler, das Frühgeburtlichkeits-Risiko, das zum Studienabbruch beim GSK-Impfstoff geführt hatte, beim Pfizer-Impfstoff dringend genauer zu untersuchen: die beiden Impfstoffe seien einander pharmakologisch zu ähnlich, als dass dieses Risiko nicht auch beim Pfizer-Impfstoff erwartet werden müsse:
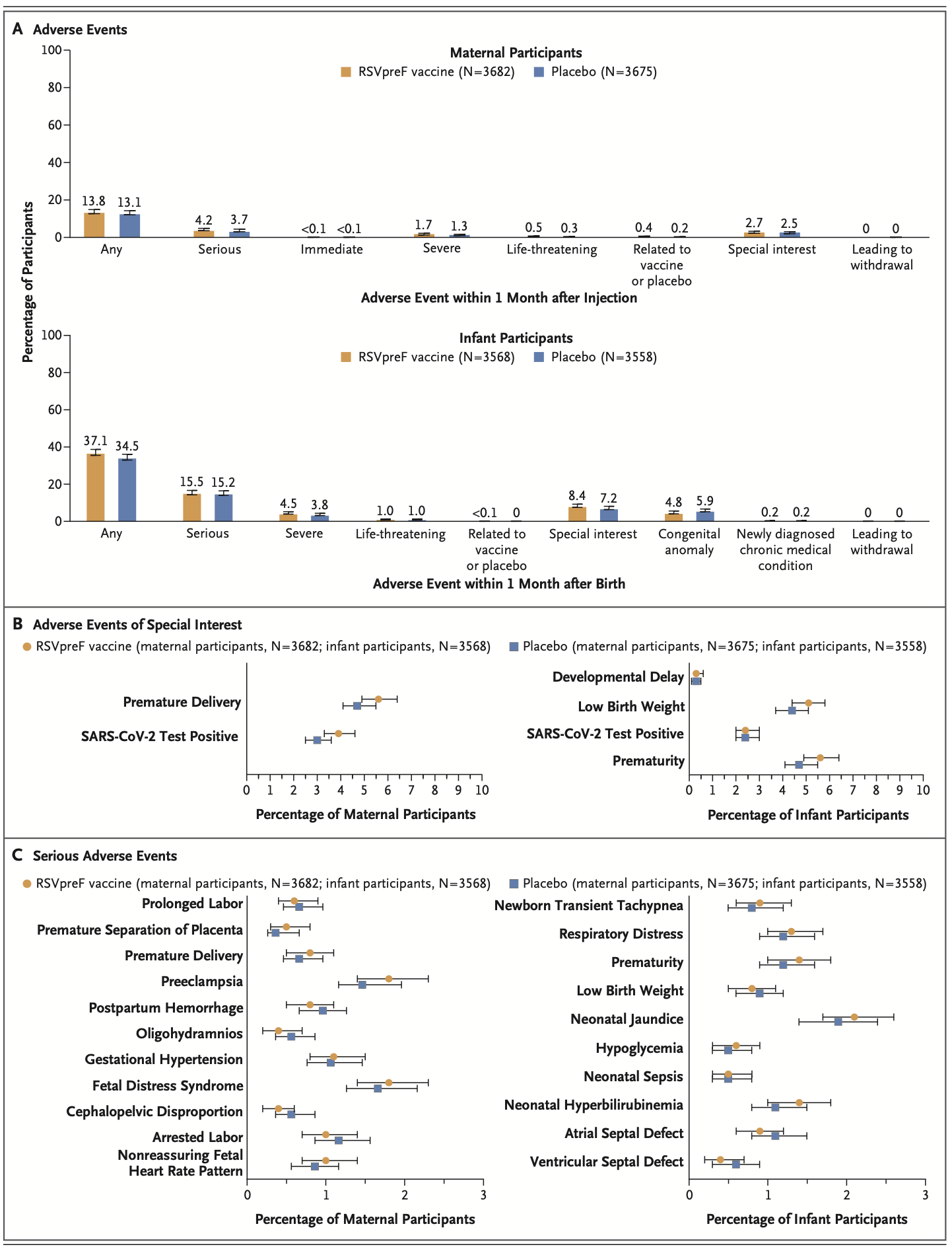
“I can’t really give you an idea as to why one would cause a problem and the other one wouldn’t,”, so eine Beraterin der US-amerikanischen CDC in dem Artikel. Tatsächlich war die Frühgeburtsrate beim Pfizer-Impfstoff sehr wohl erhöht im Vergleich zur Kontrollgruppe, dies war jedoch statistisch nicht signifikant. "Differences in preterm births are evident in Pfizer’s RSV trial. In adverse event tables for its phase 2 study, published in October 2022, Pfizer reported 3 out of 116 (2.6%) premature births in the placebo group and 6 out of 114 (5.3%) in the group that received the vaccine that was chosen as Pfizer’s final product." (Boytchev 2023).
Die US-amerikanische Arzneimittelbehörde FDA schränkte die Zulassung sicherheitshalber aber auf die Anwendung ab der 32. Schwangerschaftswoche ein, da Frühgeburtlichkeit ab diesem Alter des ungeborenen Kindes mit einem geringeren Risiko einhergeht (FDA 2023b).
Die europäische EMA ignoriert die Sicherheitssignale und folgt dem Wunsch des Herstellers mit einer Zulassung ab der 24. Schwangerschaftswoche (EMA 2023b)
Eine retrospektive Beobachtungsstudie untersuchte als primären Endpunkt 2024 die Frage, ob die Anwendung des RSV-Impfstoffs von Pfizer bei schwangeren Frauen das Risiko einer Frühgeburt erhöhe - in dieser Studie wurde kein erhöhtes Risiko geimpfter Frauen nachgewiesen (Son 2024). Es fand sich jedoch ein deutlich erhöhtes Risiko für Bluthochdruck nach der Impfung...
Methodisch ist diese Studie aus mehreren Gründen nur begrenzt belastbar, was zum einen am Design als retrospektive Beobachtungsstudie liegt, zum anderen wurden 15 nach der 37. Schwangerschaftswoche geimpfte Frauen der Gruppe der Ungeimpften zugerechnet, weil ab diesem Zeitpunkt keine "Frühgeburt" (primärer Studienendpunkt) mehr möglich ist - die sekundären Studienendpunkte werden dadurch aber natürlich u.U. verfälscht.
Sonstige Nebenwirkungen/UAWs
Andere Nebenwirkungen des Impfstoffs wurden über einen für Impfstudien ungewöhnlich langen Zeitraum erfasst: innerhalb von 6 Monaten traten bei den geimpften Frauen Nebenwirkungen abgesehen von Muskel- und Kopfschmerzen insgesamt nicht häufiger auf, als in der Kontrollgruppe. Auffallend waren jedoch in der Impfgruppe ein Fall einer schweren Autoimmunerkrankung (Lupus erythematodes) und ein Todesfall durch postpartale Blutung. Bei den Kindern wurden akute Diagnosen erfasst und zusätzlich chronische Diagnosen über einen Zeitraum von 12, im ersten Studienjahr sogar über 24 Monate. Auch hier gab es keine signifikanten Unterschiede. Allerdings war die Studie nicht wirklich placebokontrolliert: als Placebo wurde nicht - wie in den wenigen guten Studien zur Impfstoffsicherheit - physiologische Kochsalzlösung verwendet, sondern der Impfstoff minus seines Wirkstoffs und minus des Aluminiumhydroxids, das in einigen RSVpreF-Zubereitungen enthalten ist.
Den Unterlagen der US-amerikanischen FDA zufolge enthält die endgültige Formulierung von Abrysvo™ offensichtlich kein Aluminium als Adjuvans (FDA 2023a) - Unterlagen der EMA stehen derzeit (25.07.2023) noch aus.
Wie zuverlässig ist dieser Wissensstand?
Die US-amerikanischen CDC (CDC 2024, CDC 2023) bewerteten den Wissensstand zur Sicherheit von Abrysvo™ im Mai 2023 und im September 2024 nach dem so genannten GRADE-Schema (das auch z.B. die STIKO zur Impfstoff-Bewertung benutzt):
Mit anderen Worten: die CDC haben zur Verlässlichkeit der Angaben zu den Risiken von Abrysvo™ ernste oder sogar sehr ernste Bedenken, vor allem eben auch zum Thema der Frühgeburtlichkeit.
Angesichts der auch von staatlichen Stellen als bedenklich niedrig eingestuften Evidenz zur Wirksamkeit und vor allem zur Sicherheit von Abrysvo™ stellt sich die Frage, ob die (Empfehlung der) Zulassung dieses Impfstoffs tatsächlich wissenschaftlich zu rechtfertigen ist. Einer Reduzierung des Erkrankungsrisikos von weniger als 1% stehen zahllose unbeantwortete, aber sehr entscheidende Fragen gegenüber.
So ist z.B. auch die mittelfristige Auswirkung dieses "künstlichen Nestschutzes" noch völlig ungeklärt: Studien zeigen, dass selbst ein natürlicher Nestschutz durch Infektion der Mutter vor der Schwangerschaft die Antikörperbildung des geborenen Kindes eine Zeit lang verringert - ein Phänomen, das wir z.B. auch von der Keuchhusten-Impfung in der Schwangerschaft kennen (so genanntes "blunting") und dessen klinische Bedeutung noch völlig unklar ist (Karron 2018, Shinoff 2008).
Boytchev H. 2023. https://www.bmj.com/content/381/bmj.p1021
CDC. 2024. https://www.cdc.gov/acip/grade/pfizer-RSVpreF-pregnant-people.html (Abruf 02.07.2024)
EMA. 2023a. https://www.ema.europa.eu/en/news/first-rsv-vaccine-protect-infants-6-months-age-older-adults
EMA. 2023b. https://www.ema.europa.eu/de/documents/product-information/abrysvo-epar-product-information_de.pdf
FDA. 2023a. https://www.fda.gov/media/169721/download
FDA. 2023b. https://www.fda.gov/media/168889/download
Kampmann B. 2023. https://www.nejm.org/doi/full/10.1056/NEJMoa2216480
Karron RA. 2018. RSV. in Plotkin's Vaccines. 7th edition. 2018
Shinoff JJ. 2008. J Infect Dis; 198:1007-1015
Son M. 2024. JAMA Netw Open. 2024;7(7):e2419268. doi:10.1001/jamanetworkopen.2024.19268